La concentrazione della prolina è uno dei parametri su cui si basa il giudizio di genuinità dei vini. In questa esperienza se ne determina la concentrazione in vini bianchi e rossi, mediante la spettrofotometria di assorbimento. Il contenuto di questo amminoacido non risulta mai inferiore a 200 mg/l e può raggiungere i 1000-2000 mg/L. Valori inferiori ai 100 mg/L caratterizzano vini sicuramente annacquati. A seconda del tipo di vino i valori minimi accettabilidi prolina sono:
- vini spumanti 150 mg/
- vini bianchi 200 mg/L
- vini rossi 250 mg/L
L'applicazione diretta della legge di Lambert e Beer (legge dell’assorbimento):
A = ε b c per il calcolo della concentrazione (mol/L) di una soluzione incognita richiede la misura dell'assorbanza ma anche la conoscenza precisa del coefficiente di estinzione molare(ε) ο del coefficiente di estinzione E1%1cm, corrispondente all’assorbanza della soluzione alla concentrazione di 1g/100 mL, quando non è possibile esprimere la concentrazione come molarità (b è noto, dato che corrisponde allo spessore della cella).
Purtroppo, e ciò dipende da vari fattori, anche strumentali, essa non può essere tabulata in modo preciso. Di conseguenza, qualsiasi metodica spettrofotometrica che voglia raggiungere una certa precisione deve prevedere il calcolo della ε nelle condizioni sperimentali dell'analisi.
Uno dei metodi più usati in spettrofotometria UV/Vis è quello della retta di taratura. Si preparano diverse soluzioni (da 3 a 5) a concentrazioni note e crescenti della specie chimica da analizzare. Riportando su un grafico (A/concentrazione) i valori letti sullo spettrofotometro, si deve ottenere una retta passante per lo zero (si applica il metodo matematico dei minimi quadrati per calcolare l'equazione della retta). Si misura l'assorbanza del campione e, con l'ausilio del grafico, si interpola la concentrazione incognita del campione (considerando l'eventuale diluizioni effettuata).


METODO
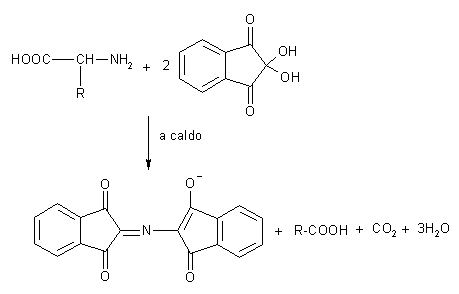
Tra gli amminoacidi, quelli aromatici, assorbono la luce nel vicino ultravioletto e possono quindi essere facilmente messi in evidenza misurando l’assorbimento di luce UV. Non potendo osservare direttamente alcuna proprietà ottica dei rimanenti amminoacidi, per la loro analisi si ricorre a reazioni colorimetriche. Tutti gli amminoacidi reagiscono, come schematizzato in figura, con un composto denominato ninidrina (2,2,3-idantrione monoidrato), formando un prodotto colorato in violetto, cha ha un massimo di assorbimento a 570 nm, la prolina essendo un imminoacido, forma un composto stabile colorato in giallo, che assorbe massimamente a 517.
Abstract:The ninhydrin reaction is one of the most reliable method for detection of amino acids in their microgram concentrations. α-Amino acids are known to react with excess ninhydrin to form a purple colored product, Ruhemann's purple. The amino acids proline and hydroxy proline (Imino acids) yield a yellow product. Under appropriate conditions, the color produced is proportional to the amino/imino acid concentration.
Primary amines also react with ninhydrin, but do not liberate of CO2. [ Caution : Ninhydrin is a very reactive oxidizing agent,so should be handled with care].
In the quantitative estimation of amino acid using Ninhydrin reagent, the absorbance of the Ruhemann's purple formed by the reaction at 570nm is measured. For imino acids, the absorbance is done at 440nm.
The Beer-Lambert law states that the amount of light absorbed is proportional to the number of molecules of absorbing substance in the light path; i.e. absorption is proportional both to the concentration of the sample solution and to the length of the light path through the solution. This relationship can be expressed as follows: Absorbance, A= ε x c x lc = concentration of the sample (in Moles/liter),
l = length of the light path through the solution (in cm) and
ε=molar extinction coefficient
To determine the absolute concentration of a pure substance, one first constructs a standard curve from known concentrations and then takes the absorbance reading of the unknown concentration. The unknown concentration can be determined from the standard curve by drawing a horizontal line on the graph parallel to the X-axis and through the point on the Y-axis which corresponds to the absorbance. This line will intersect the standard curve; at this intersection, a vertical line is drawn to the X-axis and the concentration read from the X-axis. A typical standard curve is depicted in the figure.
Materiale occorrente
beute da 25 mL
bicchiere da 600 mL
bottiglia a spruzzetta in polietilene
carta millimetrata
cuvette di policarbonato da 1 cm
imbuto di vetro a gambo corto
sette matracci tarati da 10 mL
occhiali di protezione
pipetta automatica Gilson P 1000 pipetta automatica Gilson P 5000
pipette Pasteur
pipetta graduata da 2 mL
provette di plastica con tappo da 10 mL
campioni di vino rosso
soluzione standard di prolina (100 mg/L)
soluzione al 3% di ninidrina in metilcellosolve
acido formico concentrato
soluzione di alcool isopropilico al 50% in acqua distillata
spettrofotometro UV/Vis a singolo raggio
spettrofotometro UV/Vis a doppio raggio (per la detrminazione dello spettro del complesso colorato)
Esecuzione
- Dalla soluzione madre di prolina (100 mg/L) prelevare con la pipette automatiche volumi di 1 mL, 3 mL, 5 mL e 7 mL, trasferirli in quattro matracci tarati da 10 mL e portare a volume con acqua distillata (contraddistinguere i matracci numerandoli).
Esecuzione
- Dalla soluzione madre di prolina (100 mg/L) prelevare con la pipette automatiche volumi di 1 mL, 3 mL, 5 mL e 7 mL, trasferirli in quattro matracci tarati da 10 mL e portare a volume con acqua distillata (contraddistinguere i matracci numerandoli).
- Trasferire quindi 0,5 mL di ognuna delle soluzioni in quattro provette numerate da uno a quattro, aggiungere 0,5 mL di acido formico e 2 mL di soluzione di ninidrina.
- Preparare un bianco (acido formico e ninidrina) in una quinta provetta.
- Effettuare una diluizione 1:20 dei campioni di vino, per ottenere valori di assorbanza che cadano nell’intervallo della retta di taratura.
- Prelevare dalle soluzioni diluite dei vini 0,5 mL e trasferirli in due provette(contraddistinguerle) aggiungendo anche in queste 0,5 mL di acido formico e 2 mL dininidrina.
- Tappare tutte le provette e porle a bagno maria bollente per almeno 15 minuti.
- Dopo aver raffreddato trasferire le soluzioni dalle provette in sette matracci tarati da 10 mL e portare a volume con la soluzione di isopropanolo.
- Effettuare la lettura dell’assorbimento di tutti i campioni a 517 nm, dopo aver azzerato con il bianco, entro 30 minuti dall’estrazione dal bagnomaria.
- Utilizzare per le misure una cella di materiale plastico (celle monouso in policarbonato).
- Attenzione: dopo ogni lettura la cella va svuotata, ambientata con piccoli volumi di un’altra soluzione, indi riempita, avendo cura di non toccare con le dita le pareti interessate alla radiazione (pareti trasparenti).
- Riportare in grafico i valori di assorbanza dei campioni a concentrazione nota di prolina, applicando il metodo dei minimi quadrati e ricavare le concentrazioni incognite (concentrazioni dei vini) in corrispondenza dei valori di assorbanza letti sulla retta di taratura costruita.
- Ricavare il valore del coefficiente di estinzione E1%1cm della prolina, applicando la legge
di Lambert e Beer. (La lunghezza del cammino ottico è di 1,00 cm).
- Per stabilire la concentrazione reale dei campioni di vino effettuare i seguenti calcoli:
mg/L prolina = C x d
dove: C = mg/L di prolina letti sulla retta di taratura
d = diluizione effettuata
Campioni di vino
aggiunta di carbone
Filtrazione
preparazione ssd prolina 100 ppm
preparazione ssl prolina
preparazione soluzione ninidrina
spettrofotometro Jenway 6300
Wavelenght:
range 320-1000nm
resolution 1 nm
accuracy +- 2 nm
bandwith 8nm
light source: Tungsten Halogen 20W 12V
spettrofotometro Spectronic 20 genesys
Wavelenght:
range 325-1100nm
repeatability +- 0,5 nm
accuracy +- 2 nm
bandwith 8nm
spettrofotometro doppio raggio Varian Cary 1
Wavelenght:
range 190-900nm
repeatability +- 0,04 nm nm
accuracy +- 0,2 nm
bandwith 0,2-4nm
standard senza ninidrina
aggiunta ninidrina allo standard
standard pronti per la misura di assorbanza
spettro di assorbimento del composto stabile prolina-ninidrina
Sheda sicurezza prolina:http://www.zetalab.it/schede/x143646.pdf
Scheda sicurezza ninidrina http://www.zetalab.it/schede/x132362.pdf
Scheda sicurezza acido formico http://www.zetalab.it/schede/x121029.pdf
Scheda sicurezza isopropanolo http://www.zetalab.it/schede/x191090.pdf